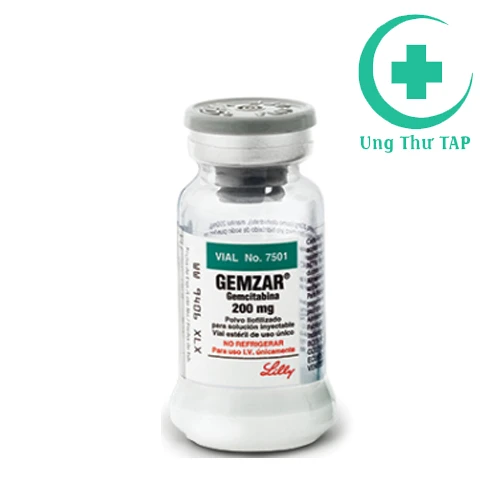
GEMZAR 200mg - Thuốc trị ung thư của Mỹ hiệu quả.
Liên hệ
Chính sách khuyến mãi
Dược sỹ tư vấn 24/7.
Khách hàng lấy sỉ, sll vui lòng liên hệ call/Zalo để được cập nhật giá
Sản phẩm chính hãng, cam kết chất lượng.
Kiểm tra hàng trước khi thanh toán.
Vận chuyển toàn quốc: 25.000đ/đơn (< 2kg)
Thông tin dược phẩm
Nhà sản xuất:
Số đăng ký:
VN-18294-14
Hoạt chất:
Hoạt chất/Hàm lượng:
Hộp 1 lọ
Hạn sử dụng:
Gemcitabin (dưới dạng gemcitabin HCl) - 200mg
Công ty đăng ký:
36 tháng
Video
Gemzar 200mg là thuốc gì?
- Gemzar 200mg là thuốc được dùng để điều trị ung thư bàng quang, điều trị ung thư tuyến tụy tiến triển tại chỗ hoặc di căn, thuốc còn kết hợp với một số thuốc khác trong điều trị ung thư buồng trứng. Ngoài ra, thuốc còn được chỉ định điều trị ung thư biểu mô tuyến tụy giai đoạn cuối, ung thư phổi.
Dạng bào chế
- Bột đông khô pha dung dịch tiêm truyền.
Quy cách đóng gói
- Hộp 1 lọ.
Thành phần – Nồng độ/hàm lượng
- Gemcitabin (dưới dạng Gemcitabin HCl) 200mg.
Thông tin về hoạt chất
- Dược lực học:
- Cơ chế tác dụng và chuyển hóa tế bào: Gemcitabine (dFdC) là một chất chống chuyển hóa pyrimidine, được chuyển hóa trong tế bào bởi men nucleoside kinase tạo thành diphosphate (dFdCDP) và triphosphate (dFdCTP) hoạt tính. Hoạt tính độc tế bào của gemcitabine là do ức chế tổng hợp DNA qua 2 cơ chế tác dụng bởi dFdCDP và dFdCTP. Trước hết, dFdCDP ức chế men ribonucleotide reductase, là men duy nhất xúc tác các phản ứng tạo ra deoxynucleoside triphosphates (dCTP) để tổng hợp DNA. Sự ức chế men này bởi dFdCDP sẽ làm giảm nồng độ deoxynucleoside nói chung, đặc biệt là dCTP. Thứ hai là, dFdCTP cạnh tranh với dCTP để gắn vào DNA (tự tăng tiềm lực).
- Tương tự như vậy, một lượng nhỏ gemcitabine cũng có thể gắn vào RNA. Như vậy, nồng độ nội bào của dCTP giảm sẽ làm cho việc gắn dFdCTP và DNA dễ dàng hơn. DNA polymerase epsilon không thể loại bỏ gemcitabine và sửa chữa được chuỗi DNA đang phát triển. Sau khi gemcitabine gắn vào DNA, một nucleotide nữa gắn thêm vào chuỗi DNA đang phát triển. Sau khi gắn thêm nucleotide này, sự tổng hợp DNA thực sự bị ức chế hoàn toàn (khóa điểm kết thúc của chuỗi). Sau khi gắn vào DNA, gemcitabine thúc đẩy quá trình hủy diệt tế bào theo chương trình định trước, được gọi là “apoptosis”.
- Dược động học:
- Dược động học của gemcitabin được khảo sát trên 353 bệnh nhân, 121 phụ nữ và 232 nam giới dao động từ 29 đến 79 tuổi. Trong số nhũng bệnh nhân này, khoảng 45% bệnh nhân ung thư phổi không phải tế bào nhỏ và 35% bệnh nhân ung thư tuyến tụy. Các thông số dược động học sau đây thu được với liều từ 500 đến 2592 mg/m2 được truyền từ 0,4 đến 1,2 giờ.
- Nồng độ đỉnh trong huyết tương (thu được trong vòng 5 phút sau khi truyền) là 3,2 đến 45,5 mcg/ml. Nồng độ trong huyết tương của hợp chất gốc sau liều 1000 mg/m2 khoảng 30 phút lớn hơn 5 mcg/ml trong khoảng 30 phút sau khi truyền xong và hơn 0,4 mcg/ml sau 1 giờ truyền.
- Phân bố
- Thể tích phân bố của khoang trung ương là 12,4 L/m2 ở nữ giới và 17,5 L/m2 ở nam giới (biến động giữa các cá thể là 91,9%). Thể tích phân bố của khoang ngoại vi là 47,4 L/m2. Thể tích phân bố của khoang ngoại vi không bị ảnh hưởng bởi giới tính. Sự gắn kết protein huyết tương được coi là không đáng kể.
- Thời gian bán thải từ 42 đến 94 phút tùy thuộc vào độ tuổi và giới tính. Đối với liều khuyến cáo, gemcitabin được đào thải trong vòng 5 đến 11 giờ khi bắt đầu truyền. Gemcitabin không tích tụ khi dùng liều mỗi tuần một lần.
- Chuyển hóa
- Gemcitabin được chuyển hóa nhanh chóng bằng cytidin deaminase trong gan, thận, máu và các mô khác. Chuyển hóa nội bào của gemcitabin tạo ra gemcitabin mono-, di- và tri-phosphat (dFdCMP, dFdCDP và dFdCTP) trong đó dFdCDP và dFdCTP được coi là có hoạt tính. Những chất chuyển hóa nội bào này không được phát hiện trong huyết tương hoặc nước tiểu. Chất chuyển hóa chính, 2′-deoxy-2 2′-difluorouridin (dFdU) không có hoạt tính và được tìm thấy trong huyết tương và nước tiểu.
- Thải trừ
- Tỷ lệ độ thanh thải hệ thống dao động từ 29,2 L/giờ/m2 đến 92,2 L/giờ/m2, phụ thuộc vào giới tính và độ tuổi (biến động giữa các cá thể là 52,2%). Độ thanh thải ở nữ giới thấp hơn ở nam giới 25%. Độ thanh thải ở cả nam giới và nữ giới dường như cũng giảm theo độ tuổi. Khi sử dụng liều khuyến cáo 1000 mg/nr truyền trong 30 phút, việc giảm độ thanh thải ở nữ giới và nam giới không dẫn đến việc phải giảm liều dùng.
- Có ít hon 10% thuốc được đào thải qua nước tiểu ở dạng không đổi. Độ thanh thải ở thận là từ 2 đến 7 L/giờ/m2. Trong 1 tuần sau khi dùng thuốc, 92-98% liều gemcitabin đã dùng được đào thải, 99% qua thận, chủ yếu ở dạng dFdU và 1% liều được thải trừ qua phân.
- Dược động học của dFdCTP
- Chất chuyển hóa này có thể tìm thấy trong các tế bào đơn nhân trong máu ngoại vi và thông tin dưới đây đề cập đến các tế bào đó. Nồng độ nội bào tăng tương ứng với liều gemcitabine từ 35-350 mg/m2/30 phút, cho nồng độ trạng thái ổn định từ 0,4-5 µg/ml. Với nồng độ gemcitabine huyết thanh cao hơn 5 µg/ml, mức dFdCTP không tăng, điều đó cho thấy nồng độ dFdCTP đã bão hòa trong các tế bào.
- Thời gian bán thải của pha thải trừ cuối cùng là: 0,7-12 giờ.
- Dược động học của dFdU
- Nồng độ đỉnh trong huyết thanh (3-15 phút sau khi kết thúc truyền liều 1000 mg/m2): 28-52 µg/ml. Nồng độ tối thiểu khi dùng liều một lần mỗi tuần: 0,07-1,12 µg/ml, không gây tích lũy thuốc. Nồng độ triphasic máu so với đường cong thời gian, thời gian bán thải trung bình giai đoạn cuối là 65 giờ (từ 33-84 giờ).
- Sự tạo thành dFdU từ hoạt chất gốc: 91%-98%.
- Thể tích phân bố trung bình trong khoang trung tâm: 18 L/m2 (từ 11-22 L/m2).
- Thể tích phân bố trung bình ở trạng thái hằng định (Vss): 151 L/m2 (từ 96-228 L/m2).
- Phân bố vào mô: phạm vi rộng.
- Độ thanh thải trung bình: 2,5 L/giờ/m2 (từ 1-4 L/giờ/m2).
- Thải trừ qua nước tiểu: Tất cả.
- Điều trị kết hợp gemcitabine với paclitaxel: Điều trị kết hợp không làm thay đổi dược động học của gemcitabine và paclitaxel.
- Điều trị kết hợp gemcitabine với carboplatin: Khi dùng kết hợp với carboplatin, dược động học của gemcitabine không bị thay đổi.
- Suy thận: Suy thận nhẹ đến trung bình (GFR từ 30 ml/phút đến 80 ml/phút) không ảnh hưởng đáng kể đến dược động học của gemcitabine.
Tác dụng - Chỉ định của thuốc Gemzar 200mg
- Gemcitabin dùng điều trị ung thư bàng quang tiến triển tại chỗ hoặc di căn, phối hợp với cisplatin.
- Gemcitabin dùng điều trị ung thư tuyến tụy tiến triển tại chỗ hoặc di căn.
- Phối hợp với cisplatin, gemcitabin là điều trị đầu tay cho các bệnh nhân ung thư phối không phải tế bào nhỏ (NSCLC) tiến triển tại chỗ hoặc di căn. Gemcitabin đơn trị liệu có thể cân nhắc dùng cho bệnh nhân cao tuổi hoặc cho bệnh nhân giai đoạn 2.
- Phối hợp với carboplatin, dùng gemcitabin điều trị bệnh nhân ung thư biểu mô buồng trứng tiến triển tại chỗ hoặc di căn, ở người bệnh tái phát sau một khoảng thời gian không thấy bệnh trở lại ít nhất 6 tháng sau khi điều trị ban đầu với các platin.
- Phối hợp với paclitaxel, dùng gemcitabin điều trị ung thư vú không thể cắt bỏ bị tái phát tại chỗ hoặc di căn mà đã tái phát sau khi hoá trị liệu bổ trợ/mới bổ trợ. Hoá trị liệu trước đó cần bao gồm một anthracyclin trừ khi lâm sàng có chống chỉ định.
Chống chỉ định của thuốc Gemzar 200mg
- Bệnh nhân mẫn cảm với bất kỳ thành phần nào của thuốc.
- Phụ nữ cho con bú
Liều lượng - Cách dùng của thuốc Gemzar 200mg
- Cách dùng:
- Gemzar được dung nạp tốt trong khi truyền và có thể đi lại được. Nếu sự thoát mạch xảy ra, nói chung phải dừng việc truyền ngay lập tức và bắt đầu lại với mạch máu khác. Nên theo dõi bệnh nhân cẩn thận sau khi truyền.
- Với các chỉ dẫn về việc hoàn nguyên, xin xem mục Hướng dẫn pha thuốc.
- Hướng dẫn pha thuốc
- Chỉ được hoàn nguyên bột tiêm gemcitabine với dung dịch natri chloride 9 mg/ml (0,9%) (không có chất bảo quản). Dựa trên khả năng hòa tan, nồng độ tối đa của gemcitabine khi hoàn nguyên là 40 mg/ml. Không nên pha thuốc ở các nồng độ cao hơn 40 mg/ml vì có thể không được hòa tan hoàn toàn.
- (1) Sử dụng kỹ thuật vô trùng trong khi hoàn nguyên và khi pha loãng thêm nữa để dùng theo đường truyền tĩnh mạch.
- (2) Để hoàn nguyên, thêm 5 ml dung dịch natri chloride 9 mg/ml vô trùng (0,9%) loại dùng để tiêm và không có chất bảo quản vào lọ 200 mg hoặc thêm 25 ml dung dịch natri chloride 9 mg/ml vô trùng (0,9%) loại dùng để tiêm và không có chất bảo quản vào lọ 1000 mg. Thể tích toàn bộ sau khi hoàn nguyên là 5,26 ml (lọ 200 mg) hoặc 26,3 ml (lọ 1000 mg). Tạo ra nồng độ gemcitabine là 38 mg/ml, đã tính cả sự thay đổi thể tích của bột đông khô. Lắc để hòa tan. Có thể pha loãng thêm với dung dịch vô trùng natri chloride 9 mg/ml (0,9%) loại dùng để tiêm và không có chất bảo quản. Dung dịch hoàn nguyên trong, không màu đến màu vàng nhạt nhẹ.
- (3) Các sản phẩm dùng ngoài ruột nên được kiểm tra bằng mắt thường về vấn đề tiểu phân và sự đổi màu. Không sử dụng nếu quan sát thấy vấn đề về tiểu phân.
- Bất kỳ sản phẩm không sử dụng nào hoặc vật liệu loại bỏ đều phải được hủy theo yêu cầu địa phương.
- Xử lý
- Phải tuân thủ những thận trọng an toàn thường quy với các tác nhân cytostatic khi chuẩn bị và xử lý hủy dung dịch tiêm truyền. Việc xử lý dung dịch tiêm truyền phải tiến hành trong hộp an toàn và nên sử dụng áo bảo vệ, găng tay. Nếu không có hộp an toàn, nên cung cấp thiết bị với mặt nạ và kính bảo vệ.
- Nếu chế phẩm bị rơi vào mắt, có thể gây kích ứng nghiêm trọng. Nên rửa mắt sạch ngay lập tức với nước. Nếu sự kích ứng kéo dài, nên tham khảo ý kiến bác sĩ. Nếu dung dịch bị đổ ra da, rửa sạch da với nước.
- Liều dùng:
- Gemcitabine chỉ nên được kê đơn bởi thầy thuốc có khả năng trong việc sử dụng hóa trị chống ung thư.
- Ung thư bàng quang
- Sử dụng phối hợp
- Liều khuyến cáo của gemcitabin là 1000 mg/m2, tiêm truyền tĩnh mạch trong 30 phút vào các ngày 1, 8 và 15 trong mỗi chu kỳ 28 ngày. Cisplatin được sử dụng liều khuyến cáo là 70 mg/m2 vào ngày 1 sau khi truyền gemcitabin hoặc vào ngày 2 của mỗi chu kỳ 28 ngày. Lặp lại chu kỳ sau mồi 4 tuần. Có thể giảm liều sau mỗi chu kỳ hoặc trong chu kỳ tùy theo mức độ độc tính gặp phải ở bệnh nhân.
- Ưng thư tuyến tụy
- Liều khuyến cáo của gemcitabin là 1000 mg/m2, tiêm truyền tĩnh mạch trong 30 phút, lặp đi lặp lại mỗi tuần một lần trong vòng 7 tuần, sau đó nghỉ 1 tuần. Các chu kỳ tiếp theo cũng bao gồm truyền tĩnh mạch 1 lần mỗi tuần trong 3 tuần liên tiếp rồi nghỉ 1 tuần. Có thể giảm liều sau mỗi chu kỳ hoặc trong chu kỳ tùy theo mức độ độc tính gặp phải ở bệnh nhân.
- Ung thư phổi không phải tế bào nhỏ
- Đơn trị liệu
- Liều khuyến cáo của gemcitabin là 1000 mg/m2, tiêm truyền tĩnh mạch trong 30 phút, lặp đi lặp lại mỗi tuần một lần trong vòng 3 tuần, sau đó nghỉ 1 tuần. Chu kỳ 4 tuần này nên được lặp lại. Có thể giảm liều sau mỗi chu kỳ hoặc trong chu kỳ tùy theo mức độ độc tính gặp phải ở bệnh nhân.
- Sử dụng phối hợp
- Liều khuyến cáo của gemcitabin là 1250 mg/m2 diện tích bề mặt cơ thể, tiêm truyền tĩnh mạch trong 30 phút vào ngày 1 và 8 của chu kỳ điều trị (21 ngày). Có thể giảm liều sau mỗi chu kỳ hoặc trong chu kỳ tùy theo mức độ độc tính gặp phải ở bệnh nhân.
- Cisplatin được sử dụng với liều từ 75-100 mg/m2 mỗi 3 tuần một lần.
- Ung thư vú
- Sử dụng phối hợp
- Khi gemcitabin kết hợp với paclitaxel, paclitaxel được khuyến cáo dùng liều 175 mg/m2 vào ngày 1, tiêm truyền tĩnh mạch trong khoảng 3 giờ; sau đó sử dụng gemcitabin với liều 1250 mg/m2 tiêm truyền tĩnh mạch trong 30 phút vào ngày 1 và 8 của mỗi chu kỳ 21 ngày. Có thể giảm liều sau mỗi chu kỳ hoặc trong chu kỳ tùy theo mức độ độc tính gặp phải ở bệnh nhân. Bệnh nhân cần phải có số lượng bạch cầu hạt tối thiểu là 1500 x 10^6/L trước khi bắt đầu điều trị phối hợp gemcitabin + paclitaxel.
- Ưng thư buồng trứng
- Sử dụng phối hợp
- Khi gemcitabin kết hợp với carboplatin, gemcitabin được khuyến cáo dùng liều 1000 mg/m2 tiêm truyền tĩnh mạch trong 30 phút vào ngày 1 và 8 của mỗi chu kỳ 21 ngày. Sau khi dùng gemcitabin, carboplatin được dùng vào ngày 1 phù hợp với vùng đích dưới đường cong (AUC) là 4,0 mg/ml/phút. Có thể giảm liều sau mỗi chu kỳ hoặc trong chu kỳ tùy theo mức độ độc tính gặp phải ở bệnh nhân.
- Theo dõi độc tính và điều chỉnh liều do độc tính
- Điều chỉnh liều do các độc tính không liên quan đến hệ tạo máu
- Nên định kỳ kiểm tra sức khỏe và chức năng gan, thận để phát hiện độc tính không liên quan đến hệ tạo máu. Có thể áp dụng giảm liều thuốc với mỗi chu kỳ hoặc trong một chu kỳ tùy vào mức độ độc tính xảy ra trên người bệnh. Nói chung, với độc tính không liên quan đến hệ tạo máu nghiêm trọng (mức độ 3 hoặc 4), trừ trường hợp buồn nôn/nôn, nên tạm ngừng điều trị với gemcitabine hoặc giảm liều phụ thuộc vào kết luận của thầy thuốc điều trị. Nên tạm ngừng cho tới khi các độc tính đã được xử trí theo quan điểm của thầy thuốc.
- Điều chỉnh liều với cisplatin, carboplatin, và paclitaxel trong liệu pháp kết hợp nên tham khảo phần tóm tắt đặc tính sản phẩm của từng thuốc tương ứng.
- Điều chỉnh liều do độc tính trên hệ tạo máu
- Bắt đầu một chu kỳ: Với tất cả các chỉ định, trước mỗi liều dùng bệnh nhân phải được theo dõi số lượng bạch cầu hạt và tiểu cầu. Bệnh nhân nên có số đếm bạch cầu hạt tuyệt đối ít nhất 1.500 (x 106/L) và số đếm tiểu cầu 100.000 (x 106/L) trước khi bắt đầu một chu kỳ.
- Trong một chu kỳ: Sự điều chỉnh liều gemcitabine trong một chu kỳ nên được thực hiện theo các bảng dưới đây:
- Điều chỉnh liều do độc tính trên hệ tạo máu trong các chu kỳ tiếp theo, cho tất cả các chỉ định
- Nên giảm liều gemcitabine tới 75% của liều bắt đầu của chu kỳ khởi đầu, trong trường hợp có các độc tính trên hệ tạo máu dưới đây:
- Số đếm bạch cầu hạt tuyệt đối < 500 x 106/L nhiều hơn 5 ngày
- Số đếm bạch cầu hạt tuyệt đối < 100 x 106/L nhiều hơn 3 ngày
- Sốt do thiếu bạch cầu hạt trung tính
- Tiểu cầu < 25.000 x 106/L
- Chu kỳ bị trì hoãn nhiều hơn 1 tuần do độc tính
- Sử dụng ở nhóm đối tượng đặc biệt:
- Bệnh nhân suy thận hoặc suy gan
- Nên sử dụng gemcitabin thận trọng ở bệnh nhân suy gan hoặc suy thận vì không có đủ dữ liệu lâm sàng để đưa ra các khuyến cáo rõ ràng cho những bệnh nhân này (xem mục Cảnh báo và thận trọng khi dùng thuốc).
- Người cao tuổi (> 65 tuổi)
- Gemcitabin được dung nạp tốt ở bệnh nhân trên 65 tuổi. Không có bằng chứng nào cho thấy cần điều chỉnh liều lượng ở người cao tuổi, trừ những khuyến cáo chung cho tất cả các bệnh nhân (xem mục Cảnh báo và thận trọng khi dùng thuốc).
- Bệnh nhân nhi (< 18 tuổi)
- Không khuyến cáo sử dụng gemcitabin ở trẻ em dưói 18 tuổi do không đủ dữ liệu về tính an toàn và hiệu quả.
- Bệnh nhân suy thận hoặc suy gan
Lưu ý đặc biệt, cảnh báo và thận trọng
- Kéo dài thời gian truyền và tăng tần số liều dùng sẽ làm tăng độc tính.
- Độc tính về huyết học:
- Gemcitabin có thể làm giảm chức năng tuỷ xương biểu hiện bằng giảm bạch cầu, tiểu cầu và thiếu máu.
- Bệnh nhân dùng gemcitabin cần được theo dõi trước mỗi liều dùng về số lượng, tiểu cầu, bạch cầu và bạch cầu hạt. Mỗi khi phát hiện có suy tủy xương do thuốc, nên cân nhắc ngừng thuốc hoặc thay đổi điều trị (xem “Liều lưọng và cách dùng” ). Tuy nhiên, suy tuỷ chỉ trong thời gian ngắn và thường không cần giảm liều thuốc và hiếm khi phải ngừng điều trị.
- Sau khi ngừng dùng gemcitabin, số lượng máu ngoại biên có thể tiếp tục bị giảm. Vớibệnh nhân có suy chức năng tủy xương, cần khởi đầu điều trị một cách thận trọng. Cùng với những thuốc kìm tế bào khác, nguy cơ tích luỹ ức chế tủy xương phải được cân nhắc khi dùng gemcitabin cùng với thuốc hoá trị liệu khác.
- Suy gan và suy thận:
- Cần thận trọng khi dùng gemcitabin cho bệnh nhân suy chức năng gan hoặc thận vì chưa đủ thông tin về nghiên cứu lâm sàng để khuyến cáo về liều lượng rõ ràng cho các đối tượng này (xem “Liều lượng và cách dùng”). Sử dụng gemcitabin cho bệnh nhân có di căn gan hoặc đã có tiền sử viêm gan cùng với nghiện rượu hoặc xơ gan có thể kéo theo đọt kịch phát của suy gan sẵn có. Cần tiến hành đánh giá thường kỳ về chức năng gan và thận (bao gồm đánh giá về virus học).
- Phối hợp với xạ trị:
- Phối hợp với xạ trị (dùng đồng thời hoặc < 7 ngày): đã xảy ra độc tính (xem chi tiết ở mục “Tương tác thuốc và các dạng tương tác khác” và khuyến cáo sử dụng).
- Tiêm chủng vaccin sống:
- Không khuyến cáo chủng vaccin sốt vàng và các vaccin sống đã giảm độc khác cho bệnh nhân dùng gemcitabin (xem “Tương tác thuốc và các dạng tương tác khác”).
- Tim mạch:
- Do có nguy cơ các rối loạn tim và/hoặc mạch máu khi dùng gemcitabin, nên phải đặc biệt thận trọng khi dùng cho bệnh nhân có tiền sử các hiện tượng tim mạch.
- Hội chứng tổn thương não phía sau có khả năng hồi phục (PRES):
- Đã có báo cáo về các trường hợp xảy ra hội chứng tổn thương não phía sau có khả năng hồi phục (PRES) với nguy cơ nghiêm trọng đã được báo cáo ở những bệnh nhân sử dụng gemcitabin đơn độc hoặc dùng chung với các thuốc hóa trị liệu khác. Đã có báo cáo các trường hợp tăng huyết áp cấp tính và co giật ở những bệnh nhân có PRES sử dụng gemcitabin, những triệu chứng khác như đau đầu, hôn mê, lú lẫn và mù cũng có thể xảy ra. Tốt nhất nên sử dụng chụp cộng hưởng từ (MRI) để chẩn đoán. Thông thường hội chứng PRES có thể phục hồi nếu có các biện pháp hỗ trợ thích hợp. Nếu trong quá trình điều trị mà hội chứng PRES tiến triển, nên dừng ngay và không lặp lại việc điều trị bằng gemcitabin và bổ sung các biện pháp hỗ trợ, bao gồm kiểm soát huyết áp và điều trị chống động kinh.
- Hội chứng rò rỉ mao mạch:
- Đã có báo cáo về hội chứng rò rỉ mao mạch ở những bệnh nhân sử dụng gemcitabin đơn trị liệu hoặc dùng phối hợp với các thuốc hóa trị liệu khác. Có thể điều trị được hội chứng này nếu phát hiện sớm và kiểm soát thích hợp, tuy nhiên cũng có báo cáo về các ca tử vong. Điều này liên quan đến tình trạng tăng tính thấm của thành mao mạch trong quá trình chất lỏng và các protein từ nội mạc bị rò rỉ vào các kễ. Các triệu chứng lâm sàng bao gồm phù toàn thân, tăng cân, hạ albumin huyết, hạ huyết áp nghiêm trọng, suy thận cấp và phù phổi. Nên dừng việc sử dụng gemcitabin và thực hiện các biện pháp hỗ trợ nếu hội chứng rò rỉ mao mạch tiến triển trong quá trình điều trị. Hội chứng rò rỉ mao mạch có thể xuất hiện ở các chu kì muộn hơn và về mặt lý thuyết thì nó có liên quan đến hội chứng suy hô hấp ở ngưòi lớn.
- Phổi:
- Khi dùng gemcitabin đã gặp các hiện tượng về phổi, có khi nghiêm trọng (như phù phổi, viêm phổi kẽ hoặc hội chứng suy hô hấp nặng ở người lớn (ARDS). Chưa rõ căn nguyên của những tác dụng này. Khi gặp những tác dụng này, cần cân nhắc ngừng điều trị. Sử dụng sớm các biện pháp chăm sóc hỗ trợ có thể giúp cải thiện tình trạng.
- Ở người dùng gemcitabin (xem “Tác dụng không mong muốn”), hiếm gặp các phát hiện lâm sàng về hội chứng urê máu tan máu (HUS). cần ngừng dùng gemcitabin khi gặp các dấu hiệu đầu tiên về bằng chứng thiếu máu tan máu bệnh vi mạch, nhu giảm nhanh hemoglobin kèm theo giảm tiểu cầu, tăng bilirubin, creatinin trong huyết thanh, tăng ure máu hoặc LDH. Bệnh thận có thể không phục hồi khi ngừng dùng thuốc và có thể cần tới thẩm tách.
- Sự sinh sản.
- Nghiên cứu trên sự sinh sản thấy gemcitabin gây thiếu hụt tạo tinh trùng ở chuột nhắt đực. Vì vậy, nam giới dùng gemcitabin phải đuợc cảnh báo không được có con trong thời gian dùng thuốc và cả 6 tháng sau khi điều trị và cần được khuyên trữ đông tinh trùng trước khi khởi đầu điều trị vì có thể có khả năng bị vô sinh do dùng gemcitabin (xem “Khi mang thai và thòi kì cho con bú”).
- Cần cân nhắc khi sử dụng ở bệnh nhân có chế độ ăn kiêng muối.
Sử dụng cho phụ nữ có thai hoặc đang cho con bú
- Thời kỳ mang thai:
- Chưa có dữ liệu đầy đủ về sử dụng gemcitabin ở người mang thai. Những nghiên cứu trên động vật cho thấy thuốc có độc tính trên sự sinh sản.
- Căn cứ vào các kết quả trên súc vật và vào cơ chế tác dụng của gemcitabin, thấy không nên dùng thuốc này trong thai kỳ, trừ khi thật sự cần thiết.
- Phụ nữ cần được dặn dò không nên có thai trong thời kỳ dùng gemcitabin và cần báo cáo ngay lập tức với bác sĩ khi có thai mặc dầu đã đề phòng
- Sinh sản
- Trong các nghiên cứu về sự sinh sản, thấy gemcitabin gây giảm sự tạo tinh trùng ở chuột nhắt đực. Vì vậy, namgiới nếu dùng gemcitabin thì không được có con trong khi dùng và cả 6 tháng sau khi dùng thuốc này và được khuyên nên trữ đông tinh trùng trước khi điều trị vì có thể có khả năng vô sinh do dùng gemcitabin.
- Thời kỳ cho con bú:
- Chưa rõ sự bài tiết của gemcitabin qua sữa người mẹ và không loại trừ được tác dụng không mong muốn của thuốc này tới đứa trẻ bú mẹ. Phải ngừng cho con bú trong thời kỳ mẹ dùng gemcitabin.
Sử dụng cho người lái xe và vận hành máy móc
- Chưa tiến hành nghiên cứu ảnh hưởng của thuốc này tới khả năng lái xe và vận hành máy. Tuy nhiên, gemcitabin có gây buồn ngủ mức độ nhẹ tới trung bình, đặc biệt khi uống cùng rượu Bệnh nhân cần thận trọng khi lái xe và vận hành máy cho tới khi xác định rõ ràng là không bị buồn ngủ
Tác dụng phụ của thuốc Gemzar 200mg
- Tác dụng phụ rất thường gặp:
- Bệnh nhân bị thiếu máu, giảm bạch cầu, giảm tiểu cầu, khó thở, nôn ói, buồn nôn.
- Bệnh nhân bị phát ban do dị ứng da thường kết hợp với ngứa, rụng tóc, tăng men gan (AST và ALT) và Phosphatase kiềm, tiểu máu, Protein niệu nhẹ.
- Bệnh nhân có triệu chứng giống cúm – phố biển nhất là sốt, đau đầu, ớn lạnh, đau cơ, suy nhược và chán ăn, ho, viêm mũi, mệt mỏi, đổ mồ hôi và khó ngủ.
- Bệnh nhân có các triệu chứng: phù ngoại biên, bao gồm cả phủ mặt, phù thường có thể hồi phục sau khi ngừng điều trị với thuốc.
- Tác dụng phụ thường gặp:
- Bệnh nhân có triệu chứng sốt giảm bạch cầu, chán ăn, đau đầu, mất ngủ, buồn ngủ, ho, viêm mũi, tiêu chảy, táo bón, viêm loét miệng, ngứa, ra mồ hôi, lưng, đau cơ, sốt, suy nhược, ớn lạnh.
- Tác dụng phụ ít gặp:
- Bệnh nhân có dấu hiệu viêm phổi mô kẽ, co thắt phế phổi.
- Tác dụng phụ hiếm gặp:
- Nhồi máu cơ tim, hạ huyết áp, tăng Gamma-Glutamyl Transferase (GGT), loét hoặc rộ da rộng, phản ứng tại chỗ tiêm.
- Tác dụng phụ rất hiếm gặp:
- Bệnh nhân bị tăng tiểu cầu, phản ứng phản vệ, tróc da và lột da nặng.
- Tác dụng phụ không rõ:
- Bệnh nhân bị loạn nhịp tim, xuất hiện hội chứng ức chế hô hấp người lớn, bỏng tỉa xạ, dịch trong, phổi, nhiễm độc phóng xạ, viêm đại tràng thiếu máu cục bộ, suy tim, suy thận, hoại tử các ngón tay hoặc ngón chân, tổn thương gan nghiêm trọng, bao gồm cả suy gan, đột quỵ.
- Bệnh nhân phải thông báo ngay cho bác sĩ những tác dụng không mong muốn gặp phải khi dùng thuốc.
Tương tác thuốc
- Chưa có nghiên cứu tương tác thuốc đặc biệt được báo cáo
- Xạ trị
- Đồng thời (dùng đồng thời hoặc cách nhau ≤ 7 ngày) – Độc tính liên quan với điều trị đa phương pháp phụ thuộc vào nhiều yếu tố khác nhau, bao gồm liều gemcitabine, tần suất sử dụng, mức độ bức xạ, kỹ thuật dự định xạ trị, mô đích, và thể tích đích. Các nghiên cứu tiền lâm sàng và lâm sàng cho thấy gemcitabine có hoạt tính nhạy cảm với tia xạ. Trong một thử nghiệm đơn, dùng đồng thời liều gemcitabine 1000 mg/m2 với liệu pháp xạ trị ở ngực cho những bệnh nhân ung thư phổi không phải tế bào nhỏ, độc tính nghiêm trọng đáng kể, và viêm màng nhầy đe dọa tính mạng tiềm ẩn, viêm thực quản, và viêm phổi đã được quan sát thấy đặc biệt ở những bệnh nhân với thể tích xạ trị lớn [thể tích điều trị trung bình 4,795cm3]. Các nghiên cứu sau đó cho rằng đó có thể là dùng gemcitabine liều thấp đồng thời cùng xạ trị với độc tính có thể dự đoán trước được, như một nghiên cứu pha II với bệnh ung thư phổi không phải tế bào nhỏ, áp dụng xạ trị ở ngực với mức 66 Gy đồng thời với sử dụng gemcitabine (600 mg/m2, 4 lần) và cisplatin (80 mg/m2 2 lần) trong 6 tuần. Chế độ điều trị an toàn tối ưu của gemcitabine với liều trị liệu xạ trị chưa được xác định ở tất cả các loại ung thư.
- Không đồng thời (cách nhau > 7 ngày) – phân tích dữ liệu không chỉ ra bất kỳ sự tăng độc tính nào khi dùng gemcitabine nhiều hơn 7 ngày trước hoặc sau phóng xạ, ngoài phản ứng phóng xạ. Các dữ liệu cho thấy có thể bắt đầu dùng gemcitabine sau khi các ảnh hưởng cấp tính của phóng xạ đã được phục hồi hoặc ít nhất 1 tuần sau xạ trị.
- Có báo cáo về tốn thương do xạ trị trên mô đích (như viêm thực quản, viêm ruột kết và viêm phổi) liên quan đến việc dùng đồng thời và không đồng thời với gemcitabin.
- Các tương tác khác
- Vắc xin điều trị sốt vàng da và các vắc xin phòng bệnh khác không được chỉ định vì ảnh hưởng nặng tới cơ thể, có thể chết người, bệnh tật, ức chế miễn dịch rõ ràng ở bệnh nhân.
Quá liều và xử trí
- Không có thuốc giải độc để điều tri quá liều gemcitabin. Đặc tính của thuốc trên lâm sàng chấp nhận được khi dùng từng liều đến 5,7 g/m2 truyền tĩnh mạch trong 30 phút mỗi 2 tuần. Khi nghi ngờ quá liều, nên theo dõi số lượng tế bào máu của bệnh nhân. Áp dụng các biện pháp điều trị hỗ trợ cho bệnh nhân khi cần thiết.
Bảo quản
- Bảo quản ở nhiệt độ không quá 30°C. Tránh ánh sáng. Để xa tầm tay của trẻ em.
Nguồn tham khảo
- Trên đây là các thông tin cần biết về thuốc Gemzar 200mg mà ungthutap.com đã tổng hợp từ các nguồn sau:
- Tờ hướng dẫn sử dụng đi kèm khi mua thuốc.
- Dược thư Quốc Gia Việt Nam mới nhất như: Drugbank, Thuốc biệt dược,Pharmog, Điều trị,…
- Nguồn thông tin y khoa uy tín trên thế giới: Drugs, WebMD, NIH,…
- Nội dung được sàng lọc kỹ lưỡng và trình bày một cách dễ hiểu nhất để bạn nắm bắt thông tin và sử dụng thuốc được dễ dàng, hiệu quả.
- Nội dung không thay thế tờ hướng dẫn sử dụng thuốc và lời khuyên từ bác sĩ. Chúng tôi không đưa ra các lời khuyên và khuyến nghị nào cho việc dùng thuốc!
Sản phẩm tương tự
Giá thuốc Gemzar 200mg là bao nhiêu?
- Gemzar 200mg hiện đang được bán sỉ lẻ tại Trường Anh Pharm. Các bạn vui lòng liên hệ hotline công ty Call/Zalo: 090.179.6388 để được giải đáp thắc mắc về giá.
Mua thuốc Gemzar 200mg ở đâu?
Các bạn có thể dễ dàng mua Gemzar 200mg tại Trường Anh Pharm bằng cách
- Mua hàng trực tiếp tại cửa hàng (Liên hệ trước khi tới để kiểm tra còn hàng hay không)
- Mua hàng trên website : https://ungthutap.com
- Mua hàng qua số điện thoại hotline : Call/Zalo: 090.179.6388 để được gặp dược sĩ đại học tư vấn cụ thể và nhanh nhất.
Câu hỏi thường gặp
Ung thư TAP hiện nay là một trong những website bán GEMZAR 200mg - Thuốc trị ung thư của Mỹ hiệu quả. chính hãng mà quý khách hàng có thể tin tưởng và đặt mua hàng. Để mua hàng tại Ung thư TAP, bạn có thể lựa chọn một trong các cách thức như sau:
- Mua hàng trực tiếp tại cửa hàng theo khung giờ sáng:9h-11h30, chiều: 2h-4h.
- Đặt hàng và mua trên website : https://ungthutap.com
- Gọi điện qua số điện thoại Hotline 0971.899.466 hoặc nhắn tin qua Zalo: 090.179.6388 để được gặp dược sĩ đại học tư vấn cụ thể và nhanh nhất.
Tuyên bố miễn trừ trách nhiệm:
Tất cả các thông tin được cung cấp trên trang web này chỉ là những thông tin tổng quan, không được xem là tư vấn y khoa và không nhằm mục đích thay thế cho việc tư vấn, chẩn đoán từ bác sĩ hay các chuyên viên y tế. Chúng tôi luôn nỗ lực để có thể cập nhật những thông tin mới và chính xác đến người đọc. Đồng thời, chúng tôi cũng không tuyên bố hay bảo đảm dưới bất kỳ hình thức nào, rõ ràng hay ngụ ý, về tính chất đầy đủ, chính xác, kịp thời, đáng tin cậy, phù hợp hoặc sẵn có với những thông tin, sản phẩm, dịch vụ hoặc hình ảnh, hay các thông tin trong văn bản có liên quan và tất cả các tài liệu khác có trên website cho bất kỳ mục đích nào. Chính vì vậy, bạn đọc không thể áp dụng cho bất kỳ tình trạng y tế của cá nhân nào và có thể sẽ xảy ra rủi ro cho người đọc khi dựa vào những thông tin đó.
Sản phẩm liên quan
Sản phẩm cùng hãng
Bình luận
Bạn hãy là người đầu tiên nhận xét về sản phẩm này